Reacción en cadena de las polimerasas
 PCR
PCR
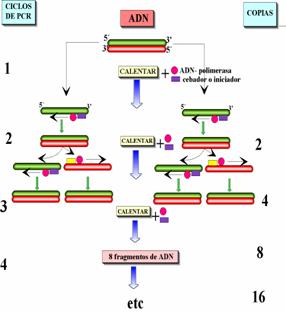
La reacción en cadena de la polimerasa tiene tres pasos que se repiten cíclicamente, 1) desnaturalización de los ácidos nucleicos, 2) alineación de un cebador iniciador (primer), y 3) polimerización, por efecto de una polimerasa termo resistente, en un medio rico de nucleótidos libres (dNTPs). En un ciclo, a partir de una molécula se obtienen dos, en el segundo ciclo de dos se obtienen cuatro y siguiendo una progresión geométrica en 30 ciclos se tendrían 1, 073, 741, 755 copias.
Para una eficiente reacción del PCR, se busca controlar numerosas variables, de las cuales las principales son: 1) Muestra de los ácidos nucleicos, 2) Condiciones químicas de la reacción y 3) condiciones físicas
Muestra de los Ácidos nucleicos
Generalmente los problemas en los resultados del PCR, están relacionados con la cantidad y calidad de ácidos nucleicos. En cuanto a la cantidad, regularmente se sugiere utilizar de 15 a 50 ng, no obstante, para la amplificación de fragmentos de ADN mitocondrial, a partir de muestras de ADN total, se amplia el rango de 15 a 200 ng, prefiriéndose los valores altos. Fuera de estos rangos es necesario utilizar técnicas complementarias o el uso de aditivos en la mezcla de reacción, lo que puede elevar sustancialmente los costos.
En cuanto a la calidad, es preferible utilizar productos del tipo C1 (una banda clara y nítida, sin barrido, ver en interpretación de la electroforesis), aunque en muestras de ADN con barrido ligero (C2 y C3), se pueden obtener resultados adecuados. En muestras degradadas, generalmente se requiere utilizar técnicas complementarias
Condiciones químicas de la reacción
En la mezcla de reacción se utilizan diversos componentes, además del ADN que sirve de molde. Los componentes de una reacción típica, incluyen un cebador hacia adelante (forward o F), uno hacia atrás (reverse o R), mezcla de los dNTPs (deoxinucleotidos), polimerasa termoresistente (Taq polimerasa), iones magnesio (en forma de cloruro de Magnesio), amortiguador y agua destilada, desionizada, ultrapurificada y esterilizada (H2Oddue). Adicionalmente, dependiendo del tipo de termociclador podría utilizarse aceite mineral.
La concentración de los cebadores F y R, ha sido ampliamente estandarizada, recomendándose utilizar de 0.5 a 1 µl de una solución con concentración de 20 µM, para una reacción de volumen total de 25 µL. La solución madre (stock), se prepara en una concentración de 50 a 100 µM, para garantizar una mejor conservación de los cebadores.
El diseño de los cebadores es básico para entender los resultados de una reacción de PCR. Es recomendable es uso de cebadores específicos, que tengan aproximadamente la misma proporción de C-G con respecto a A-T, evitando la formación de pasadores (dobleces del cebador durante la reacción) o la formación de dimeros simples o pareados (unión de bases complentarias) por unión entre el mismo cebador o entre los cebadores.
Los dNTPs se agregan en exceso para cubrir adecuadamente las demandas de la reacción. En una reacción de 25 µL, es común utilizar 2 µL de una concentración de 2.5mM. Agregar una mayor cantidad implica un desperdicio de los nucleótidos, además de que pueden interferir en la reacción.
La primer polimerasa termo resistente utilizada fue a Taq polimerasa, de la cual se utilizan de 0.25 a 1 unidad por reacción, no obstante, en la actualidad existen al menos 10 polimerasas de uso en las reacciones de PCR, de las cuales las más comerciales son las obtenidas de Pyrococcus furiosus (Pfu), Thermococcus litoralis (Vent o Tli). Generalmente de la solución madre, se utilizan de 0.5 hasta 2 µL por reacción.
El magnesio es requerido para una adecuada función de la polimerasa y se recomienda una concentración de 1.65 mM por reacción. En casos especiales, se puede utilizar hasta 4mM, aunque con el riesgo de disminuir la especificidad en la acción de la polimerasa. La preparación de la solución madre de 25 o 50 mM, es laboriosa y requiere de filtrado y esterilización de los reactivos, las que pueden ser muy difíciles de lograr en un laboratorio general, por lo que se recomienda adquirirla de proveedores especializados.
El pH y el balance iónico, se logra con el uso de un amortiguador termo resistente, con tris-HCl (pH8.4) y cloruro de potasio. Cabe aclarar que en la reacción debido a los cambios de temperatura el pH variara desde aproximadamente 7 hasta 10. La preparación es sumamente complicada, por lo que se sugiere adquirirlas de una compañía especializada.
Finalmente para el agua, es posible obtenerla de un ultrapurificador y esterilizarla, manteniendola en el área de trabajo de PCR.
Para lograr una mayor eficiencia en la reacción es posible agregar diversos aditivos, como formamida, DMSO o Tween 20 (se recomienda revisar la página de internet: http://www.staff.uni-mainz.de/lieb/additiva.html), los cuales son utilizados generalmente de forma empírica.
Comercialmente se encuentran disponibles juegos de mezclas para PCR, como PCR-super mixer, en los cuales incluyen total o parcialmente los reactivos requeridos, de tal forma que solo se requiere agregar la muestra a amplificar.
Lamentablemente en estos juegos, la polimerasa puede perder actividad después de unas semanas o meses y típicamente recomiendan su uso antes de que se cumplan los seis meses de preparación. En los casos que se exceda el tiempo de conservación, suele ser requerido suplementar la mezcla con polimerasa fresca.
En síntesis la mezcla de reacción típica incluye los siguientes componentes y concentraciones:
Reactivo |
Concentración final |
dNTPS |
0.2 mM (rango de 0.05 a .25 mM) |
Iniciador F |
0.4 mM (rango de 0.2 a 1 mM) |
Iniciador R |
0.4 mM (rango de 0.2 a 1 mM) |
Taq-Polimerasa |
0.2 U (rango de 0.2 a 1 U) |
Cloruro de magnesio (MgCl2) |
1.65 mM (rango 1.5 a 4 mM) |
ADN (molde o templete) |
15 a 200 ng |
Amortiguador |
1.1 X |
Agua (H2O ddue) |
Volumen necesario para la reacción |
En los primeros termocicladores no se contaban con mecanismos para mantener la temperatura homogénea en todo el interior de los tubos de reacción, por lo que se agrega de uno a dos volúmenes de aceite mineral, previamente esterilizado y conservado en el área de trabajo de PCR.
Condiciones físicas
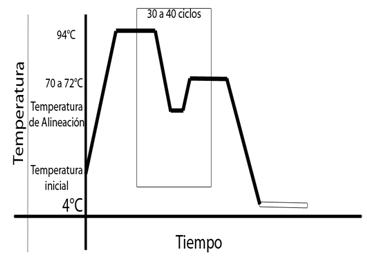 Un ciclo regular requiere de cuatro etapas:
Un ciclo regular requiere de cuatro etapas:
1) desnaturalización inicial,
2) ciclos de desnaturalización, alineación y polimerización,
3) polimerización final y
4) conservación. La desnaturalización inicial, se puede lograr eficientemente con 94 °C durante 5 minutos.
Si existe la sospecha de que las muestras no están completamente purificadas (sospecha de proteínas), se puede elevar la temperatura inicial hasta los 96 °C durante 2 minutos y después a 94 °C por los 3 minutos restantes.
Para algunos PCR, como el de RAPDs, puede ser recomendable omitir la desnaturalización inicial. La polimerasa puede perder efectividad durante la desnaturalización inicial, por lo que algunos fabricantes recomiendan agregarla después de esta desnaturalización inicial.
Los ciclos, comprenden una desnaturalización inicial de 94 °C por 30 segundos, la alineación a la temperatura de alineación promedio o de fusión (TM por sus siglas en ingles) por 30 segundos y la polimerización a 72 °C por 1 minuto por cada mil pares de bases.
La temperatura de alineación promedio, se toma a partir de los datos del fabricante de los cebadores o se calcula con la siguiente ecuación empírica:
Calculo de TM (método de G-C)
Por ejemplo para la secuencia: ttc ccc ggt ctt gta aac c
N= 10 # GC= 10 %GC= 52%
Tm= 2°C * (A+T) + 4°C * (G+C) == 2 * (9) + 4 (10) = 58°C corrección 58-5= 53°C
Nota: Se define TM (Temperatura de fusión) como la temperatura a la cual el 50 % de los acidos nucleicos se mantiene disociado o desnaturalizado
El número de ciclos esta limitado por la eficiencia de la polimerasa, estableciéndose un rango de entre 25 a 40 ciclos. Una mayor cantidad de ciclos puede producir bandas fantasmas u otras aberraciones en los productos del PCR.
Las variantes en los ciclos son diversas de acuerdo a las condiciones obtenidas en la estandarización.
Las principales variaciones son:
- Incrementar en uno a dos segundos por ciclo el tiempo de la polimerización, cuando se obtienen barridos o con baja eficiencia.
- Variar la pendiente de cambio entre temperaturas, principalmente entre la alineación y polimerización, cuando hay baja eficiencia en la reacción y en la electroforesis se observan los oligos.
- Realizar 5 a 6 ciclos iniciales, con 1 a 4 grados arriba de la temperatura de alineación, cuando la reacción es sumamente específica para un fragmento y las falsas alineaciones generan resultados erróneos.
- Realizar de 5 a 6 ciclos iniciales, con 1 a 4 grados abajo de la temperatura de alineación, cuando se obtiene baja eficiencia.
La polimerización final se realiza a 72 *C por 10 minutos, posteriormente se programa al termociclador en un tiempo de espera a 4 *C y se conservan los productos en refrigerador.
El aceite mineral generalmente no produce problemas en la manipulación de los productos del PCR, no obstante puede ser necesario eliminarlo, para lo cual se puede introducir el tubo a -70 °C y una vez solidificada la muestra, se puede retirar fácilmente el aceite por decantación, o deposita el contenido del tubo en un pedazo de parafilm de donde se recoge posteriormente el producto de PCR.
Otros cuidados
Considerando la gran sensibilidad de la reacción de PCR, en un análisis, se deben extremar los cuidados en:
- Proteger de cualquier fuente de contaminación, tanto a los materiales como a los reactivos.
- Trabajar con guantes limpios, la protección pertinente y en una campana de flujo laminar tipo I o II.
- Hacer reproducibles todas las variables posibles alrededor de los experimentos.
- En la extracción de ADN, se debe eliminar los otros compuestos orgánicos presentes en la muestra (residuos de fluidos orgánicos), así como los residuos de los reactivos utilizados en la reacción (SDS, fenol, cloroformo, alcohol y el exceso de sales).
- En un estudio, mantener el mismo paquete de materiales y reactivos, ya que el cambio de uno de ellos puede requerir una nueva estandarización.
Nota final: La ropa requerida para efectuar un PCR, busca proteger al máximo a la muestra y a los reactivos de cualquier contaminación e incluye accesorios como cubre bocas y gorra de laboratorio.

