PRÁCTICA 13: Electroforesis
INTRODUCCION:
Generalidades de la electroforesis
La electroforesis es el movimiento de partículas eléctricamente cargadas a través de un gas o líquido como resultado de un campo eléctrico formado entre unos electrodos sumergidos en el medio. En nuestro caso, la técnica se aplica para la separación por tamaño de los fragmentos en los ácidos nucleicos. Por efecto de la corriente eléctrica directa, las moléculas se mueven a través de una matriz inerte (de polímetros de agarosa o acrilamida), que se encuentra en un amortiguador, todos estos durante un tiempo determinado.
 |
Considerando las características de las muestras, son diversas las variables que intervienen en la electroforesis y que es necesario controlar. Las principales a considerar son: características de la muestra, corriente eléctrica (Volts, Watts y Amperes), amortiguador, matriz (tipo y concentración) y otros reactivos.
Descripción de la electroforesis
La electroforesis es el movimiento de partículas eléctricamente cargadas a través de un gas o líquido como resultado de un campo eléctrico formado entre unos electrodos sumergidos en el medio. En nuestro caso, la técnica se aplica para la separación por tamaño de los fragmentos en los ácidos nucleicos. Por efecto de la corriente eléctrica directa, las moléculas se mueven a través de una matriz inerte (de polímetros de agarosa o acrilamida), que se encuentra en un amortiguador, todo esto durante un tiempo determinado.
 |
Características de la muestra
Considerando las características de las muestras, son diversas las variables que intervienen en la electroforesis y que es necesario controlar. Las principales a considerar son: características de la muestra, corriente eléctrica (Volts, Watts y Amperes), amortiguador, matriz (tipo y concentración) y otros reactivos.
Previo a la realización de una electroforesis, se debe tener una idea del tamaño de los fragmentos, para tomar adecuadas decisiones en las variables a controlar. La información requerida es mínima y puede ser subjetiva, separando los tamaños de las moléculas en tres categorías simples:
Tamaños grandes, fragmentos mayores de 2,000 pares de bases (pb)
Tamaños medianos, de entre 500 y 5,000 pb
Tamaños pequeños, menores de 1,000 pb
Corriente eléctrica
Las tres variables a considerar son Volts, Watts y Amperes. Estas se relacionan directamente, la molécula será arrastrada por la fuerza del voltaje. El wattaje, está relacionado con la resistencia del medio y la intensidad de corriente, el efecto de valores altos producirá calor.
Los ácidos nucleicos son atraídos hacia el polo positivo o ánodo (generalmente señalado con el color rojo), debido a configuración que deja expuestos a los grupos fosfato, particularmente a los átomos de oxígeno. Por tal motivo en la matriz electroforética la muestra se coloca proximal al polo negativo o cátodo (con el color negro).
En las técnicas con ácidos nucleicos generalmente solo nos ocupamos de regular el voltaje y evitamos los efectos del calor, utilizando voltajes alrededor de 5 V/cm. Como regla empírica, utilizamos mayores voltajes cuando deseamos separar moléculas grandes y menores voltajes para moléculas de tamaño pequeño.
En resumen, los voltajes utilizados de acuerdo al tamaño de fragmento esperado, son los siguientes:
|
Nota: es posible utilizar voltajes mayores hasta de 10 V/cm, dependiendo de las necesidades experimentales.
Cuando se utiliza una gran resistencia en el medio (por ejemplo, por alta concentración en la matriz, altos voltajes, cambio en el amortiguador), para contrarrestar el calentamiento podemos introducir la charola de electroforesis en el refrigerador o utilizamos un sistema de enfriamiento para el amortiguador, y lo bombeamos a través de la charola.
Amortiguador
Los amortiguadores deben reunir varias características, entre las que se incluyen: a) adecuada conductividad, b) estables a diferentes temperaturas, c) pH neutro que facilite el arrastre de las moléculas sin desnaturalizarlas y d) capacidad de castrar iones magnesio y calcio, los cuales pueden ser cofactores para la acción de las exonucleasas.
En forma convencional se utilizan los amortiguadores denominados TBE (Tris-borato-EDTA) y TAE (tris-acetato-EDTA). El primero favorece la electroforesis de moléculas chicas a medianas, en cambio el segundo para moléculas grandes a medianas. El amortiguador, en las electroforesis de agarosa, cubre totalmente a la matriz inerte, pero es deseable que no exceda la superficie en más de 4 mm, ya que se pueden producir algunas aberraciones
Al igual que los reactivos de uso cotidiano, los amortiguadores se preparan más concentrados que la solución de uso, brindando una mayor durabilidad a TA. En el caso del TBE, se prepara en una concentración 5X y se usa a 0.5X, en el caso del TAE de 50X y se usa a 1 X. El EDTA di sódico utilizado, puede requerir mucho tiempo en su preparación, por lo que típicamente se prepara una solución 10X, garantizando que las soluciones queden cristalinas. Sin este cuidado, cuando se mezclan los componentes del amortiguador concentrado se obtiene una solución lechosa, con una rápida precipitación de sus componentes.
Matriz
La matriz para la electroforesis se elabora con un polímero con las siguientes características:
1) no debe modificar a las moléculas de las muestras,
2) permita un eficiente paso de la corriente,
3) se pueda regular el tamaño del poro para favorecer el paso de las moléculas de acuerdo a su tamaño y
4) debe ser de fácil preparación y manipulación.
Los polímeros utilizados más comúnmente son la agarosa y la acrilamida. La primera, es de uso rutinario en una concentración de 0.8% y funciona más eficientemente con moléculas de medianas a grandes, pero si se incrementa la concentración o si se agregan aditivos, permite la visualización de moléculas pequeñas, inclusive a nivel de unidades o decenas de bases.
La matriz de acrilamida, utilizada en electroforesis verticales, permite una más eficiente regulación del tamaño de los poros que se forman entre los polímeros y se puede obtener una mayor resolución, por lo que es posible diferenciar tamaños de moléculas que difieren de solo una base. El proceso de preparación de la acrilamida es más laborioso y requiere cuidados especiales en su preparación. Es comúnmente preferido el uso de agarosa y se reserva el uso de la acrilamida para verificar el tamaño de bandas en muestras problemáticas o para tomar las fotografías para las publicaciones.
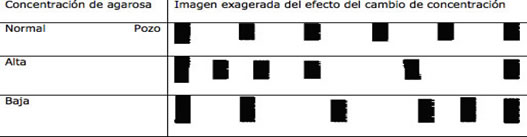
En forma empírica se ha establecido el uso de concentraciones altas (de 1 al 4%) para estudiar moléculas chicas, contrastantemente, las concentraciones menores del 0.8% y hasta el 0.4%, se utilizan para moléculas grandes. En concentraciones altas, para contrarrestar el efecto de la resistencia traducida en calor se utilizan bajos voltajes (menores de 5 V/cm hasta 2.5 V/cm), y en concentraciones rutinarias del 0.8 % o menores, es posible elevar el voltaje (hasta 10 V/cm), a pesar de que se puede generar una aberración debida a la velocidad de arrastre de las moléculas.
Las concentraciones recomendadas dependiendo del tamaño del fragmento esperado, son las siguientes:
|
Imagen exagerada del efecto del cambio de concentración
Otros reactivos.
Considerando que las electroforesis horizontales son submarinas, para evitar o al menos disminuir la difusión de la muestra, se homogeniza con una solución hiperdensa de sacarosa (de hasta 4 M), a la que se le agrega azul de bromo fenol, que además tiñe a la muestra, permite verificar el avance de la electroforesis, debido a que avanza a una velocidad similar a la de moléculas de unos 500 pares de bases.
Dependiendo del experimento que se realice, a la solución híper-densa de azul de bromo fenol, se le pueden agregar otros reactivos, como urea que permite mantener parcial o totalmente desnaturalizados a los ácidos nucleicos, así como para desnaturalizar a las enzimas que se utilicen (como las endonucleasas) o que estén en el medio (como las exonucleasas, DNazas y RNazas).
Finalmente, para visualizar los fragmentos de los ácidos nucleicos, típicamente se utiliza Bromuro de Etidio, el cual se intercala entre las bases y fluorece con la luz ultravioleta Este reactivo es mutagénico y peligroso para la salud humana en bajas concentraciones, pero se puede manipular con cuidados básicos y resulta relativamente económico.

Para incorporar el bromuro en los ácidos nucleicos, se utilizan dos estrategias:
1) se agrega en el gel durante su preparación o
2) se “baña” el gel en una solución de agua con bromuro, durante 5 a 10 minutos y se enjuaga el excedente.
Cuando se trabaja con bromuro de etidio incorporado al gel, se agrega justo antes de la polimerización de la agarosa, por lo que se sugiere utilizar guantes en los siguientes pasos.
Es importante aclarar, que el bromuro de etidio es atraído hacia el polo negativo (al contrario que los ácidos nucleicos), lo cual se debe tomar en cuenta para establecer la estrategia de tinción más adecuada, ya que, si se busca teñir fragmentos muy pequeños, el bromuro puede rebasarlos y en consecuencia no se logren visualizar.
Cuantificación de ADN
Para la cuantificación del ADN, existen dos métodos indirectos que permiten estimar la concentración del ADN en las muestras, por visualización y mediante espectrofotómetro. En este curso solo se explicara la estimación por visualización.
Estimación de la concentración de ADN por visualización.
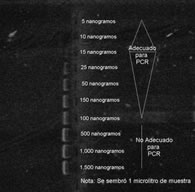
El método indirecto más recomendable para la determinación de la concentración de ADN en una muestra es mediante la visualización de un gel de electroforesis en el cual se colocan muestras con concentraciones conocidas.
El procedimiento requiere la preparación de una cámara de electroforesis, colocando cada una de las muestras que se desea evaluar en pozos individuales y dejando al menos 10 pozos libres.
Posteriormente se inicia la electroforesis con 6 v/cm y diez minutos antes de que concluya la corrida, se detiene la fuente de poder, se destapa la cámara de electroforesis, sembrando muestras de concentraciones conocidas.
Finalmente se cierra la cámara de electroforesis, se enciende nuevamente la fuente de poder, dejando que corra durante 10 minutos, se visualiza el producto con U.V. y se toma una fotografía.
En este método la estimación se realiza contrastando intensidades de luz entre las muestras, lo cual se realiza visualmente o con el auxilio de algún programa computacional que contraste intensidades de color.
 |
Competencia: Valorar diferentes metodologías de la tecnología de ADN a nivel celular para ejemplificar su aplicación, con actitud profesional
Materiales y Equipos
Tubos cónicos de centrífuga de 1.6 mL
Pipetas Pasteur con bulbo.
Micropipeteas automáticas
Extracción de ADN
¿Qué debe llevar al laboratorio?
CUIDADO EN LA SESION SE UTILIZA BROMURO DE ETIDIO el cual es considerado MUTAGENICO, TERATOGENICO Y CARCINOGENICO
Preparación agarosa en horno de microondas
Para verificar el producto de las extracciones de ADN en el curso, se realiza una electroforesis en gel de agarosa al 0.8 %. Considerando que se trabaja con bromuro de etidio incorporado al gel, se recomienda enfáticamente utilizar guantes en todos los siguientes pasos.
1. En la preparación del gel para las cámaras de electroforesis chicas (minisub), coloque en un matraz Erlenmeyer 0.24 gr. de agar y agregue 20 ml del amortiguador TAE 1x.
2. Coloque el matraz en el horno de micro-ondas con el máximo poder hasta la ebullición, retire y homogeneice, repitiendo hasta que la solución sea cristalina.
3. Transfiera el agar a la charola de electroforesis y coloque los correspondientes peines.
4. Después de 15 minutos, con el agar solidificado, retire con cuidado los peines, jalándolos hacia arriba, en forma recta.
Electroforesis
1. Coloque la charola en la cámara de electroforesis.
2. Agregue a la cámara 300 ml de amortiguador TAE 1x (hasta que se cubran los pozos con el amortiguador)
3. En un tubo de centrífuga o sobre parafílm, coloque 8 m l de la muestra*.
4. Agregue 2 µ l de Azul de bromofenol y agua destilada para llevar el volumen final a 10 µ l.
5. Con el pipeteador automático homogeneice la muestra y transfiérala a uno de los pozos del gel de agar. Tenga cuidado de no rasgar los pozos o el gel.
6. Repita los tres últimos pasos para el resto de las muestras dejando al menos un pozo para colocar la escalera del fago lambda digerido con HindIII, según las instrucciones del fabricante.
7. Revise las conexiones, que los pozos estén el polo negativo y encienda la fuente de poder programando el voltaje constante entre 2 y 5 V/cm (en la cámara minisub son aproximadamente 80 V, por 45 minutos). Con el menor voltaje se obtiene una mejor resolución de bandas, especialmente con fragmentos chicos.
8. 8.- Permita que avance la electroforesis hasta que el azul de bromofenol recorra 2/3 de la distancia del gel.
9. Apague la fuente de poder y retire cuidadosamente el gel.
10. Visualicé el resultado de la electroforesis en un transiluminador U.V.
NOTA: RECUERDE QUE LA LUZ U.V. PUEDE PRODUCIR EFECTOS NOCIVOS INMEDIATOS. CUANDO VISUALICE VERIFIQUE QUE ESTÁ USTED ADECUADAMENTE PROTEGIDO.
Nota: * La cantidad de muestra que se agregue variara dependiendo de la concentración de ADN. En la visualización cuando se agrega un exceso de ADN se observan aberraciones dendríticas en la muestra, por el contrario, si se agrega una baja concentración (menos de 5 ng) no se observara el ADN.
Estime la concentración de ADN por visualización.
Recomendaciones para plasmar los resultados y su análisis
Anote las modificaciones del protocolo
Analice el trabajo realizado y los resultados. Se recomienda fotografiar e imprimir los resultados, para pegar la foto en la libreta. Interprete todo lo que se observa en el gel.

