PRÁCTICA 8: Cloroplastos
INTRODUCCION:
En la sesión se busca promover el desarrollo de habilidades para la separación de plastos y su observación. Para el reporte de práctica se recomienda investigar el marco de referencia teórico de la sesión.
Competencia: Comparar los métodos utilizados para la identificación de orgánelos en tejidos multicelulares, con base en la utilización de técnicas básicas, para su posterior aplicación en el campo profesional, con disciplina y respeto.
Materiales y equipos
Tubos eppendorf
Tubos de centrífuga
Homogeneizador
Amortiguador STE y TEK (Tris-HCl 50 mM pH 7.5; EDTA 10 mM y KCl al 1.5%)
Sacarosa
Centrífuga eppendorf
Centrífuga refrigerada
Mini fuga
¿Qué debe llevar al laboratorio?
Microscopio compuesto y papel para limpiar microscopio
Al menos 1 gramo de tejido vegetal fresco, como espinacas. Un plátano, un jitomate chico, una papa.
Metodología:
Primera parte: Separación y observación de plástidos
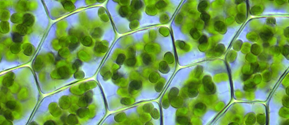
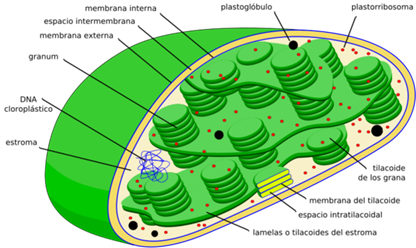
Los cloroplastos de las células de espinaca se aislarán utilizando el método modificado de F.R Whatley y D.I. Arnon (1962).
- La espinaca se homogeniza en un amortiguador de sal.
- Después que el tejido de la planta se macera en un mortero, el homogenizado se filtra a través de una gaza para remover los pedazos grandes de tejidos.
- El filtrado es centrifugado a 200 g por 1 minuto.
- El sobrenadante se centrífuga a 1300 g por 5 minutos, sedimentando los cloroplastos.
Aislamiento de la fracción de cloroplastos
1. Pese 2 g de hojas frescas de espinaca, a las cuales se les removieron las venas centrales.
2. Corte las hojas en pequeños pedazos y colóquelas en un mortero sometido a temperatura de congelación.
Añada 15 ml de la solución amortiguadora de Tris-NaCl fría y arena purificada. Macere el tejido por 2 minutos. Realice el macerado con cuidado para no producir espuma.
3. Filtre la suspensión a través de varias capas de gaza a un tubo de centrífuga de 15 ml frío (en hielo).
4. Centrifugue el líquido filtrado a 200 g por 1 minuto a 4 ºC. Verifique que los tubos de centrífuga estén balanceados.
5. Decante el sobre nadante a un tubo frío y centrifugue a 1300 g por 5 minutos.
6. Decante y descarte el sobre nadante y usando una probeta, añada unas gotas de la solución amortiguadora fría de Tris-NaCl al “pellet” que quedó en el tubo de centrífuga. Con cuidado re suspenda el “pellet” con una pipeta Pasteur.
8. Tape el tubo de centrífuga, e invierta el mismo para mezclar su contenido. Colocar en hielo.
Observación microscópica de la fracción de cloroplastos
1. Con una pipeta Pasteur remueva una gota de la suspensión de cloroplastos y lleve a cabo una preparación húmeda. Use una pequeña gota de modo que no tenga que ejercer presión sobre el cubreobjetos, dañando los cloroplastos.
2. Examine los cloroplastos bajo el objetivo de alta potencia y luego y luego bajo el objetivo de inmersión en aceite.
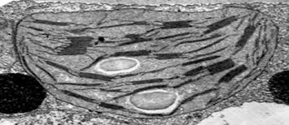
3. Observa la morfología de varios cloroplastos. Identifica los cloroplastos que tengan una morfología interna poco homogénea.
4. Represente con un diagrama los cloroplastos que muestren detalles internos e identifique sus estructuras.
|
||
 |
Observación microscópica de los cloroplastos tratados con urea
1. Coloque una pequeña gota de la suspensión de cloroplastos en un portaobjetos limpio. Añada una gota de la solución de urea saturada y coloque un cubreobjetos. Cuidado de no presionar el cubreobjetos.
2. Examine los cloroplastos bajo el objetivo de alta potencia y el de inmersión de aceite.
3. Dibuje los cloroplastos que presenten una morfología alterada.
Observación microscópica de los cloroplastos tratados con detergente
1. Prepare un montaje húmedo usando una pequeña gota de la suspensión de cloroplastos y una gota de solución de SDS al 20%.
2. Examine la preparación bajo el objetivo de alta potencia y el de inmersión de aceite
Identificación de cromoplastos
1. De un tomate maduro corte finamente una pequeña porción de la parte pulposa.
2. Coloca el tejido sobre un portaobjetos, sin adicionar agua y se protege con un cubreobjetos.
3. Comprima suavemente la preparación con los dedos hasta obtener un completo aplastamiento del fragmento de pulpa de tomate.
4. Examinar la preparación al microscopio con el objetivo 10x y seleccionar una zona en la que las células estén menos aglutinadas.
5. Examinar la preparación al microscopio con los objetivos 40x y 100x (aceite de inmersión).
6. Identificar los distintos orgánulos celulares visibles y dibujar las observaciones. Al microscopio se observan unas células muy separadas unas de otras, apreciándose en el citoplasma una serie de gránulos rojizos-anaranjados que son los cromoplastos. También se puede ver el núcleo redondeado. En las zonas poco alteradas por la compresión es posible visualizar grandes vacuolas incoloras, así como la presencia de gránulos de almidón en forma arriñonada.
 |
 |
Observación de amiloplastos
1. Un plátano maduro se abre y con cuidado se corta muy finamente, colocando el material en un portaobjetos y distribuyéndolo procurando hacer un frotis, con la misma navaja.
2. Fijar la muestra por secado a temperatura ambiente (3 min.)
3. Agregar una gota de lugol y mantenga a temperatura ambiente durante 3 minutos.
4. Lavar suavemente con agua destilada.
5. Colocar un cubreobjetos y comprimir suavemente la preparación con los dedos.
6. Examinar la preparación al microscopio con el objetivo 10x y seleccionar una zona en la que las células estén menos aglutinadas. Posteriormente examine con los objetivos 40x y 100x (aceite de inmersión), cerrando el diafragma hasta el máximo permitido por el foco luminoso.
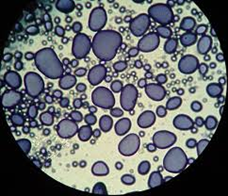
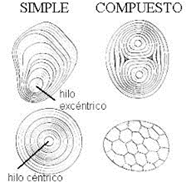
7. Identifique los distintos orgánulos celulares visibles. Los amiloplastos se observan como estructuras ovaladas y de tamaño considerable, por lo general, muestran capas concéntricas de crecimiento del grano, las cuales son muy variadas y específicas de cada especie de planta, fruto o semilla. En el plátano, los granos de almidón se tiñen de color violeta al reaccionar con el lugol.
 |
 |
Observación de leucoplastos.
El reactivo lugol, que se utiliza para observar estas estructuras, es a la vez una fijador (agente químico que destruye las células sin modificar su estructura) y un colorante de algunos tejidos vegetales (celulósicos, lignificados y suberificados), así como de sustancias de reserva (almidón), siendo de gran interés para el reconocimiento de diferentes especies vegetales, pues cada especie, dentro del mismo género, presenta distinta organización de los tejidos y almacena el almidón de forma diferente.
De la papa se toma una porción y se raspa con la punta de la lanceta. Se deposita el raspado sobre el portaobjetos y se añade una gota de agua y otra de lugol. Se coloca un cubre y se observa al microscopio.
Los gránulos de almidón se tiñen de color azul-violeta intenso por el yodo. Se pueden observar las capas de crecimiento excéntricas, que presentan los gránulos de almidón alrededor de un punto central.
 |
Recomendaciones para plasmar los resultados y su análisis
Describa en cada protocolo lo que sucede en cada paso.
Analice cada uno de los pasos, con base en la información teórica de la práctica, es decir interprete lo que se hace en cada paso.
Con base en el análisis, describa puntualmente lo que aprendió.