PRÁCTICA #2: Microscopia
INTRODUCCION:
En una primera parte se busca promover la exploración rápida de algunas células eucariontes, como lo son las células sanguíneas, para lo cual se debe conocer el adecuado uso de los microscopios compuestos y el uso de la iluminación Kölher. En forma adicional se promoverá el desarrollo de habilidades asociadas a la tinción Hematoxilina-Eosina.
Para el reporte de práctica se recomienda investigar el marco de referencia teórico de la sesión y conteste las siguientes preguntas
¿Cuáles son los tipos de microscopio útiles en la actividad relacionada con la biología celular y molecular?
¿Cuáles son las principales características de los microscopios compuestos?
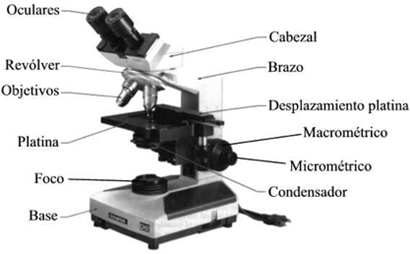
Copie un esquema de un microscopio compuesto
¿Cuáles son las principales recomendaciones para el uso del microscopio?
El microscopio es un instrumento delicado. Debido a esto debe recordar las siguientes instrucciones básicas:
a) Coloque el microscopio en una posición cómoda sobre la mesa. Tómelo siempre del brazo. Si desea cambiar la posición del instrumento levántelo y NO lo arrastre por la mesa.
b) Es conveniente verificar la limpieza de los lentes antes de comenzar a realizar observaciones.
c) Encienda la lámpara, baje el condensador y abra el diafragma completamente. Recuerde, la observación se realiza más eficientemente con iluminación Köheler.REPORTE EN EL ALMACEN DE MICROSCOPIOS CUALQUIER ANOMALIA
 |
Realización de la observación
a) Aleje el objetivo de la platina y coloque la lente de aumento menor (4x).
b) Seleccione la preparación que desea observar, revísela para asegurarse que esta se encuentra limpia.
c) Abra la pinza del carro, coloque la preparación con el cubreobjetos hacia arriba y cierre el carro.
d) Ajuste la posición del carro de modo que la región a observar quede justo en el orificio de la platina.
e) Usando el macro métrico acerque la lente a la preparación. Cuando logre un foco aproximado utilice el micrométrico (gírelo lentamente) para el ajuste de precisión.
f) Si desea cambiar el aumento, gire el revólver y seleccione el nuevo objetivo a utilizar. Debiera bastar un pequeño ajuste del micrométrico para llegar a foco, si fuera necesario reajuste la iluminación usando el condensador.
Si requiere usar el lente de inmersión (100x en los microscopios de la FC) NUNCA lo use como objetivo seco, puede rayarlo.
Uso del objetivo de inmersión
a) La preparación debe estar enfocada a 40X (objetivo a seco), gire el revólver de modo que el objetivo de inmersión quede en una posición intermedia (40X y 100X).
b) Coloque una gota de aceite de inmersión sobre el cubre objeto.
c) Lleve el objetivo de inmersión al eje óptico.
d) Utilizando el tornillo micrométrico lleve el objeto a foco, si lo requiere modifique la cantidad de luz del condensador.
e) Cuando finalice la observación baje la platina, retire la preparación. Limpie tanto el objetivo como la preparación con un paño humedecido con Xilol.
Al finalizar las observaciones el microscopio y las preparaciones deben quedar limpios. Gire el revólver y deje la lupa como lente de observación. Apague la lámpara y enrolle el cordón en el pie del microscopio.
Recomendaciones para plasmar los resultados y su análisis
Debe seguir una estructura, que puede variar según el observador, pero que debe ser sistemática y ordenada. Se sugiere que considere en sus observaciones el siguiente esquema:
a) Objetivo: referido al porque se realiza la observación (Ej. observación de núcleo)
b) Material: es el órgano o tejido del que se obtuvo la preparación (Ej. riñón de rata)
c) Método: se refiere a la técnica histológica usada para elaborar la preparación (a fresco o permanente) y a la tinción utilizada. (Ejemplo Preparación a fresco de células)
d) Aumento: la amplificación del objeto observado y depende del ocular y del objetivo.
Aumento = aumento del objetivo x aumento del ocular
e) Observaciones: considere describir la forma celular; relación con otros elementos presentes, tamaño celular; forma, número y posición del núcleo y algunas características del citoplasma
f) Esquematice y coloree lo observado
El Dr. Köheler, desarrolló un nuevo sistema de iluminación, que aún hoy en día se maneja y lleva su nombre, agregando un diafragma de campo luminoso posterior a la emisión de luz emitida por un bombillo de bajo poder, y centrando la mayor intensidad de luz exactamente cubriendo el diámetro de cada lente frontal de cada objetivo en su apertura numérica específica, para de esta manera, poder al 100% la luz emitida por la fuente emisora.
 |
COMPETENCIA: Categorizar los métodos de estudio aplicados a la Biología y Fisiología Celular, para su tipificación, con base en la utilización practica de algunas de ellos, para su posterior aplicación en el trabajo profesional con responsabilidad.
MATERIAL:
5 Portaobjetos y 5 cubreobjetos
Hematoxilina
Eosina
Alcohol etílico absoluto
¿Qué debe llevar al laboratorio?
Disposición para obtener una gota de sangre
Un esquema, dibujo o foto con los tipos de células sanguíneas de humano
Microscopio compuesto para iluminación Köheler y papel para limpiar microscopio
Metodología:
Protocolo para iluminación Köheler
1.-Llevar el espécimen a foco utilizando el objetivo 10X.
2.-Cerrar completamente el diafragma del condensador.
3.-Cerrar completamente el diafragma de campo.
4.-Con el control de altura del condensador llevar el condensador hasta arriba5.-Bajar el condensador poco a poco hasta observar una figura geométrica (octágono) bien definida con el reborde ligeramente azulado.
6.-Con los tornillos de centrado del condensador colocar el octágono al centro del campo de observación.
7.-Abrir el diafragma de campo hasta que una de las aristas toque el borde del campo de observación y repetir el centrado hasta que todas las aristas toquen el borde del campo de observación al mismo tiempo.
8.-Cambie al objetivo 40X.
9.-Abrir el diafragma del condensador a la apertura numérica marcada por el objetivo.
10.-Observando con un solo ojo (derecho) mover el mando micrométrico hasta obtener el mejor punto de enfoque.
11.-Observando con el otro ojo (izquierdo) sin tocar el micrométrico gire la dioptría hasta obtener el mejor punto de enfoque.
12.- Cambie al objetivo 10X.
13.- Abrir el diafragma del condensador a la apertura numérica marcada por el objetivo.
14.- Sí el espécimen se mantiene en foco, los ajustes se hicieron correctamente, de lo contrario repita desde el punto 8 hasta lograr el correcto ajuste.
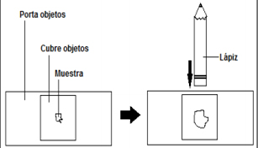
1. Coloque la muestra sobre el portaobjetos y si es posible utilice el cubreobjetos.
2. Utilizando la iluminación Kölher y optimizando la iluminación, observe las células.
3. Incremente el aumento hasta 40X y 100x utilizando adecuadamente el aceite mineral.
4. Esquematice sus observaciones, indicando los datos de la muestra o la laminilla y técnica de tinción. En el caso de que utilice fotografías, con auxilio de un procesador de imágenes, muestre sus observaciones, delimite y nombre a las células y orgánelos o estructuras que observe.
No se olvide utilizar ampliamente el sistema de iluminación, así como la profundidad de campo y el uso del micrómetro para el adecuado enfoque por cada campo.
En los casos en donde las muestras pueden quedar muy gruesas se realiza lo que se denomina “squash” (del verbo aplastar).
 |
Tinción simple.
- Raspar suavemente con un palillo limpio la cara interna de la mejilla.
- En un portaobjeto coloque unas dos o tres gotas de agua y enjuague el palillo, homogenizando y extendiendo las gotas sobre el porta.
- Caliente sin que llegue a quemar el dorso de la mano con el portaobjetos.
- Agregar unas gotas de azul de metileno, dejando actuar el colorante 2 o 3 minutos.
- Elimine el colorante sobrante y lavando con agua hasta que no suelte color.
- Utilizar un cubreobjetos colocándolo suavemente.
 |
Tinción de Hematoxilina- Eosina (HE)
1. Obtención una gota de sangre o muestra de células.
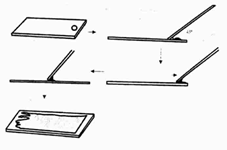
2. Realización del frotis sanguíneo. Se hace colocando una pequeña gota de sangre sobre un extremo del portaobjetos, con el lado de otro porta, en un movimiento uniforme, extiende la gota sobre el primer porta.
 |
3. Secar el frotis al aire.
4. Fijar del frotis con alcohol absoluto (agregar alcohol sobre la muestra hasta cubrirla totalmente, dejar que el alcohol se evapore totalmente).
5. Tinción con hematoxilina (agregar el colorante sobre la muestra hasta cubrirla totalmente, esperar exactamente 15 minutos, echando más colorante si éste se evaporara).
6. Lavar abundantemente con agua para que el colorante sobrante desaparezca y deje de actuar.
7. Tinción con eosina (agregar el colorante sobre la muestra y dejar actuar durante 1 minuto exactamente).
8. Lavar abundantemente con agua para que el colorante sobrante se elimine y no siga actuando.
9. Secar al aire.
10. Observar al microscopio comenzando con pocos aumentos.
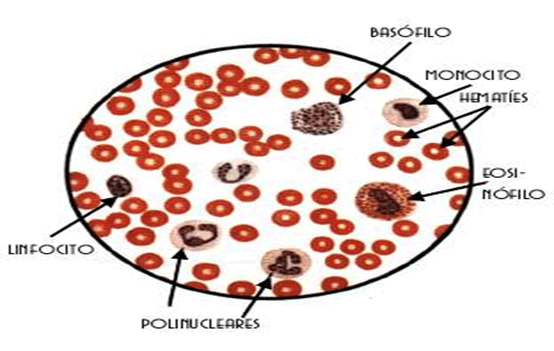
En la observación dominaran en el campo visual los glóbulos rojos, hematíes o eritrocitos, teñidos en color rojo que se caracterizan por carecer de núcleo y son más delgados por el centro que por los bordes.
Los glóbulos blancos (leucocitos) de identifican por la presencia de núcleo. Hay varias clases de glóbulos blancos:
- linfocitos de mayor tamaño que los glóbulos rojos, con un notable núcleo que ocupa casi todo el citoplasma.
- monocitos son los leucocitos grandes, poco frecuentes. Tienen un núcleo muy grande y redondeado que aparece teñido en color violeta.
- polinucleares presentan el núcleo fragmentado.
- eosinófilos, con granulaciones abundantes de color rojizo y el núcleo teñido de color azul marino. Estos glóbulos aumentan su número en caso de parasitosis o procesos alérgicos.
- basófilos presentan un núcleo teñido de rojo y las granulaciones del citoplasma de color muy oscuro.
Estimación del tamaño de los objetos en el microscopio
Con el microscopio se puede ampliar un objeto dependiendo de la capacidad de los objetivos y oculares, de tal forma que, si se tiene un ocular de 10X y el objetivo de 4X, entonces se aumenta el tamaño del objeto 40 veces. En los microscopios de la FC- UABC se pueden obtener hasta de 10X por 100X, es decir 1,000 aumentos.
Tomemos en cuenta que con la vista humana promedio sólo puede tener resolución (es decir la capacidad de discriminar dos puntos separados) por más de 0,1 mm o 100 micrómetros (µm o mm). La mayoría de las células son más pequeñas, por lo que se necesita utilizar microscopio óptico para realizar las observaciones, considerando su límite de resolución de 0,2 µm o mm (200 nm).

Una forma rápida de estimar el tamaño del campo de observación es el uso de células de fácil obtención y de tamaño estándar, como son los glóbulos rojos, los cuales miden de 5 a 7,5 μm de diámetro, de 1 μm de grosor.
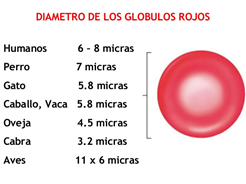 |
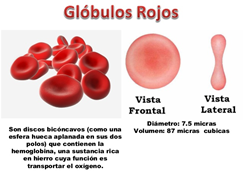 |
Otra forma rápida consiste en el uso de papel milimétrico, el cual se coloca en el portaobjetos y una vez que se enfoca adecuadamente, con cada objetivo, se puede utilizar como referencia para las sucesivas mediciones.

