PRÁCTICA 12: Tecnología de ADN
INTRODUCCION:
En una primera parte se practicarán diversos protocolos de extracción de ADN para posteriormente evaluar su calidad y cantidad utilizando métodos electroforéticos. Con el objetivo de buscar la mayor racionalización en las actividades que se desarrollaran se explican los pasos de las metodologías que se utilizarán.
Para el reporte de práctica se recomienda investigar el marco de referencia teórico de la sesión, así como la introducción para el reporte, por parte del estudiante
Competencia: Valorar diferentes metodologías de la tecnología de ADN a nivel celular para ejemplificar su aplicación, con actitud profesional
Generalidades de los protocolos.
El primer paso de los métodos moleculares, aplicados a los estudios poblacionales es la extracción del ADN. En la extracción de ácidos nucleicos, existen cinco etapas principales: 1) conservación de tejidos, 2) homogenización de tejidos, 3) degradación y eliminación de compuestos orgánicos diferentes al ADN o ARN, 4) precipitación de los ácidos nucleicos y 5) resuspensión y conservación.
Conservación
Para la conservación de tejidos existen diversas alternativas, las cuales son utilizadas de acuerdo a las condiciones específicas de trabajo. La técnica de mayor eficacia es la de crio-conservación en nitrógeno líquido, pero lamentablemente es la que presenta una mayor dificultad en su aplicación, ya que son requeridos recipientes especiales y facilidades para la adquisición del nitrógeno líquido.{
Una alternativa fácil de aplicar en cualquier lugar de México, es la combinación entre el uso de “Hielo seco” (dióxido de carbono comprimido), para el transporte de muestras hasta el laboratorio y la conservación en ultracongelador a temperaturas menores de -70 °C. Con el hielo seco también se pueden congelar rápidamente las muestras, ya que al ponerlo en contacto con alcohol o éter, disminuye notablemente la temperatura y para protección de las muestras solo se requieren utilizar bolsas de plástico. En trabajo de campo, se recomienda poner en una bolsa de plástico a la muestra, la cual se introduce en otra bolsa, a la que se le agrega el hielo seco y el alcohol, resultando una reacción inmediata que literalmente congela a la muestra.
Otras alternativas, incluyen el uso de etanol, con el que se deshidrata rápidamente la muestra, o soluciones hipersalinas con DMSO al 20% y en casos especiales la deshidratación con el sol así como con otros agentes castrantes de la humedad.
Homogenización
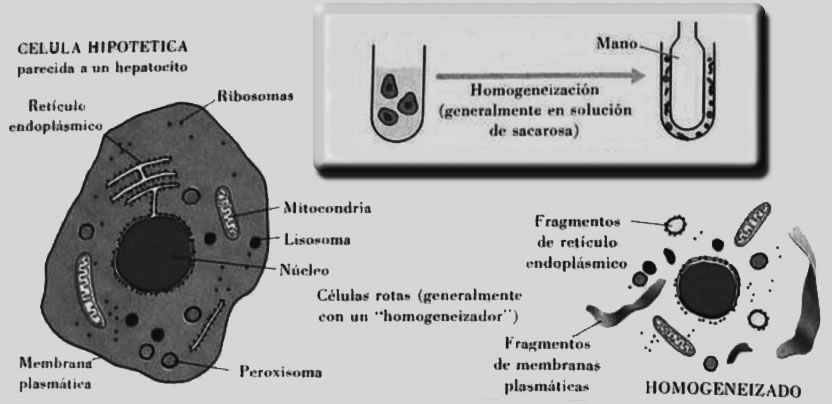
Para facilitar la degradación de los tejidos, sin dañar los ácidos nucleicos, podemos combinar el uso de métodos físicos con los químicos. El más eficiente de los métodos físicos, involucra la congelación de la muestra y su posterior macerado en un mortero precongelado. La congelación más recomendable se logra con nitrógeno líquido y como método alternativo, con el uso de “hielo seco” y etanol.
Debido a las dificultades operativas de estas técnicas, es posible utilizar homogeneizadores de vidrio (Potter Elvehjen) y lo más común, es el macerado con una navaja sobre una superficie sólida, como podría ser un portaobjetos.
Posteriormente se aplican métodos de homogenizado químico, con detergentes (para desnaturalizar los lípidos) y enzimas que facilitan la degradación de las proteínas (como proteinza K). Con soluciones amortiguadoras se mantienen las condiciones salinas (con KCl 1 mM) y de pH neutro en la muestra (Tris-HCl, 0.25mM, pH 7.8 a 8.0). Adicionalmente se agrega EDTA (0.02 a 1.0 mM), como agente castrante de los iones magnesio y calcio, requeridos para la acción de las exonucleasas que degradan los ácidos nucleicos.
Para garantizar una adecuada reacción, los tejidos macerados, se colocan en tubos de 1.5 ml, con el amortiguador (TES, TEK o TEN), el detergente (comúnmente SDS al 0.2 % u otros detergentes no iónicos como el IGEPAL) y proteínas K, posteriormente se tapan herméticamente y se mantienen en agitación constante, con temperaturas desde la ambiental (TA) hasta los 65 °C. Cabe aclarar que el tiempo de digestión química, varía dependiendo de la naturaleza del tejido y la técnica de conservación, ocupándose desde una hasta veinticuatro horas. Los tiempos y cantidades de reactivos se deben estandarizar, buscando evitar la sobre digestión por efecto de las exonucleasas.
Otros agentes utilizados en el homogenizado químico son la albumina (al 0.5% para remover ácidos y fosfolípidos), sorbitol o manitol (balance iónico), carbonato de sodio (controlar la concentración de sales), sacarosa (mantener la densidad del medio).
Degradación y eliminación de compuestos orgánicos
Para la degradación de los compuestos orgánicos, generalmente se utiliza fenol estabilizado, cloroformo estabilizado con alcohol isoámílico o cloroformo. Dependiendo de la técnica de conservación, así como de las condiciones y tipo de tejido, se elige la técnica más adecuada. Para la eliminación de los compuestos, en cada paso se utilizan técnicas de centrifugación, con velocidades superiores a 10,000 xg con tiempos superiores a los 5 minutos.
Precipitación de los ácidos nucleicos
Después de la eliminación de los compuestos orgánicos, en solución quedan los ácidos nucleicos, debido a su alto gradiente de sedimentación en agua (o en el amortiguador). Para precipitarlos, a la solución se le incrementa notablemente la salinidad (con acetato o cloruro de sodio) y se le agrega alcohol y posteriormente es centrifugado en velocidades superiores a 10,000 xg por más de 10 minutos.
Cabe aclarar, que comúnmente son utilizados dos tipos de alcohol, el etanol y el isopropanol. Con etanol, se necesita facilitar la precipitación utilizando temperaturas bajas por largos periodos (la noche a -20 °C o una hora a -70 °C). En algunos casos, pueden requerirse sucesivos lavados con alcohol, para eliminar las sales.
Una vez formado el precipitado (el cual puede no observarse a simple vista), se elimina el alcohol, por centrifugación, decantación y evaporación. El precipitado de los ácidos nucleicos, en caso de que se observe, pasara de un color blanquecino, cuando está húmedo, a uno semi transparente, cuando está totalmente seco. Es importante eliminar totalmente el alcohol y las sales, ya que pueden interferir con las reacciones posteriores.
Resuspensión y conservación
Para la resuspensión, es prudente considerar el uso que se le dará al ADN. En el caso de requerir la muestra por unos cuantos días, para PCR (reacción de polimerasas en cadena, por sus siglas en ingles), el precipitado obtenido previamente puede resuspenderse en agua que preferentemente haya sido destilada, des ionizada, nano purificada y esterilizada (H20•ddue).
Para una aplicación general se conserva en TE y en algunos casos es recomendable agregarle enzimas que degraden el ARN, como la RNAza. La posterior conservación se realiza a bajas temperaturas, como la de -20 °C cuando se utilizará en las siguientes semanas, o a -80°C para mantenerla por meses o incluso años.
Los protocolos específicos para la extracción del ADN dependerán de las muestras y costos de extracción permisibles (en tiempo y esfuerzo), que van desde unos cuantos pesos hasta decenas de pesos. En el primer caso, con costos muy bajos, encontramos las técnicas de extracción fenólica o de cloroformo que requieren al menos unas 4 horas de dedicación.
En el mercado existen juegos comerciales, con un costo de alrededor de 3 a 6 veces el equivalente al de una extracción convencional, pero que requieren generalmente una hora de trabajo en laboratorio y generalmente con una mayor garantía de reproducibilidad.
Competencia: Valorar diferentes metodologías de la tecnología de ADN a nivel celular para ejemplificar su aplicación, con actitud profesional
Materiales y Equipos
Pinzas
Navajas de un solo filo
Portaobjetos esteril
Tubos cónicos de centrífuga de 1.6 mL
Pipetas Pasteur con bulbo.
Micropipeteas automáticas
¿Qué debe llevar al laboratorio?
Tejido fresco para la extracción de ADN
Métodos de extracción de ADN
Extracción de ADN por el método de cloroformo
1. Homogeneizar el tejido (40 a 200 mg) con 613µL de solución de lisis (10mM Tris; 400 mM NaCl; 2 mM Na2*EDTA) 30µL SDS (al 20% en TEN -solución de lisis-) y 7 µl de proteinaza K (20 µg /ml). La mezcla se homogeneiza y se mantiene en agitación constante de 5 a 24 horas.
Nota: es importante verificar la adecuada agitación durante la primera hora, regla empírica, recuerde que con bajo tiempo de digestión hay poca separación de ADN, contrastantemente un tiempo prolongado puede incrementar el tiempo de exposición a las Dnazas, del mismo tejido, y en consecuencia también hay poca obtención de ADN. Un tiempo generalmente adecuado es de 12 a 14 horas (overnight).
2. Al tubo se le agregan 375 µl de NaCl 6M (previamente filtrado). Para lograr una adecuada homogeneización puede utilizar el Vortex durante 10 segundos, y se centrífuga en TA (temperatura ambiente) por 15 min. a 14,000 xg.
3. Pasar a un tubo limpio los 780 µl de la fase superior, se le agregan 750 µl de Cloroformo, y después de homogeneizar completamente (con vortex 10 segundos), se centrífuga a 10,000 rpm por 10 min.
4. Posteriormente se toman aproximadamente 750 µl del sobrenadante, evitando tomar o tocar la interfase que contiene proteínas. Considere que es preferible tomar menos líquido, pero no contaminado.
5. Al sobrenadante se le agregan 750 µl de Isopropanol, se homogeneiza. Es recomendable dejar reposar el tubo en posición vertical, durante unos 30 min a TA o en refrigerador, para facilitar la precipitación del ADN.
6. Las muestras son centrifugadas a 10,000 rpm por 15 min, TA.
7. El sobrenadante es retirado cuidadosamente, procurando no perturbar el fondo del tubo, en donde está depositado el ADN.
8. Para secar el precipitado (pellet), se deja el tubo abierto a 37 C, durante media hora o se coloca en un sistema de vacío.
9. Finalmente el pellet seco, se resuspende con 50 µl de TE.
Para conservar la muestra se guarda en congelación a –20 C (durante meses) o a –80 ºC (durante años).
Extracción Salina
Descrito por Aljanabi y Martínez (1997)
1- De 30 a 200 mg de tejido se homogeneiza en 400 μl del amortiguador STE (0.4 M NaCl, 10 mM Tris-HCl pH 8.0, 2 mM EDTA pH 8.0), 40 μl de SDS 20% (concentración final 2%) y 8 μl de Proteinasa K (20mg/ml)
2- Las muestras se incuban a 55 °C durante 1.5 h a toda la noche; se mantienen los tubos cerrados hasta que alcanzaran la temperatura ambiente para evitar contaminación cruzada por escape de aerosoles entre muestras.
3- Se añaden 300 μl de NaCl 6M (NaCl saturado en H2O) y mezclan por 30 s a 1200 r.p.m.
4- Centrifugar por 30 min a 10,000 g.
5- La fase acuosa es transferida a un tubo nuevo y se le añade un volumen igual de isopropanol absoluto, mezclado e incubado al menos por 1 h a -20 °C.
6- Las muestras son centrifugadas a 12,000 g a 4°C por 20 min., descartado el sobrenadante y el pellet es lavado con etanol 75%
7- El precipitado es secado y resuspendido en 50 μl de TE pH 8.0 (Tris-HCl 10 mM, EDTA 1 mM) y almacenado a -80 °C hasta su uso.
Extracción de ADN con CTAB
1. Aproximadamente de 10 a 40 mg de tejido se colocan en un tubo eppendorf de 1.5 ml.
2. Al tubo se le agregan 200 µl de solución de lisis (200 mM Tris Base, pH 7.4; 0.5 % SDS; 250 mM NaCl y 25 mM EDTA*Na2). La mezcla se homogeneiza y se mantiene en agitación constante durante 20 minutos. Nota: es importante verificar la adecuada agitación.
3. A la muestra agregarle 200 µl de solución CTAB (CTAB 2%, PVP 0.1 %, SDS 0.1%, 0.2 ß- mercanoetanol, 100 mM TRIS base 10 mM y 20 mM EDTA*Na2), y se mantiene a 65 C.
4. Se agregan 300 µl de LiCl 5M, logrando una adecuada homogeneización y se centrifuga en TA (temperatura ambiente) por 15 min. a 14,000 xg.
5. A un tubo limpio con 780 µl del sobrenadante, se le agregan 750 µl de Cloroformo, y después de homogeneizar completamente (con vortex 10 segundos), se centrifuga a 10,000 rpm por 10 min.
6. Posteriormente se toman aproximadamente 750 µl del sobrenadante, evitando tomar o tocar la interface que contiene proteínas.
7. Al sobrenadante se le agregan 750 µl de Isopropanol, se homogeneiza. Es recomendable dejar reposar el tubo en posición vertical, durante unos 30 min a TA o en refrigerador, para facilitar la precipitación del ADN.
8. Las muestras son centrifugadas a 10,000 rpm por 15 min, TA.
9. El sobrenadante es retirado cuidadosamente, procurando no disturbar el pellet donde está depositado el ADN.
10. Para secar el precipitado, se deja el tubo abierto a 37 C, durante media hora o se coloca en un sistema de vacío.
Finalmente, el precipitado seco, se resuspende con 50 µl de TE.
Recomendaciones para plasmar los resultados y su análisis
Contraste los resultados contra lo esperado de acuerdo a la bibliografía

